Нашатырный спирт в саду и огороде: как и зачем применять
Содержание:
Содержание средств «нашатырный спирт» и «аммиак»
НС-это раствор, производный от нитрида водорода. Является жидкостью без цвета с специфическим запахом. Другое название — гидроксид аммония. Такое название обусловлено тем, что зачастую НС получается при разбавлении аммиака водой. Таким образом получается 10% водный раствор.
Его химическая формула — NH4OH. Группа «HOH» указывает на то, что в растворе содержится вода, а «NH3» указывает на связь с самим аммиаком. Оно состоит из азота, кислорода и водорода.
Гидроксид аммония вступает в реакцию с солями, кислотами, кислотными оксидами, тем самым проявляя основные свойства. К примеру:
NH4OH+ H2SO4= (NH4)2SO4+H2O
Была получена соль- сульфат аммония, которая выпала в осадок, то есть осталась вода и бесцветные кристаллы соли.
реакция с кислотными оксидами:
Была получена соль-гидросульфит аммония, которая представляет собой кристаллы без цвета, легко растворимые в воде.
Был получен хлорид аммония (нашатырь) и в осадок выпал гидроксид алюминия.
Таким образом можно заметить, что во всех случаях гидроксид аммония образует соли аммония.
Теперь рассмотрим аммиак. Его химическая формула- NH3. Он также обладает резким специфическим запахом, но является газом, а не жидкостью. Легко растворяется в воде и обладает плотностью меньше воздуха (примерно в 2 раза). Данное вещество состоит из азота и водорода и практически не проводит электрический ток.
Данное соединение имеет огромное значение в промышленности. Во многих реакциях проявляет основные свойства. Вступает в реакцию с водой и кислотой. В некоторых случаях проявляет себя как кислоту, во много раз слабее воды. К примеру:
В результате выделяется газ- водород и получается соль-нитрид калия.
В результате реакции образовалась соль- нитрат аммония.
Можно заметить, что нитрид водорода проявляет как основные, так и кислотные свойства (в редких случаях) и образует соли.
Соблюдение мер предосторожности при работе с нашатырем
Отличительной особенностью нашатырного спирта является его едкий запах. С подобными препаратами необходимо соблюдать правила работы, чтобы е причинить вред себе и растениям.

- Вдыхание паров спирта может привести к резкому подъему давления. Поэтому все работы необходимо проводить в закрытой одежде, резиновых перчатках, маске и очках.
- Раствор готовьте на открытом воздухе или хорошо проветриваемом помещении. При обработке pастений в теплице, сразу проветрите ее.
- Если средство попало на слизистые оболочки, следует быстро промыть пораженный участок проточной водой.
- Чтобы не обжечь растения, следуйте приведенным выше рекомендациям по использованию аммиака.
- На грядках обработку лучше проводить в безветренную, сухую погоду, предварительно полив pастения водой.
- При использовании нaшатырного cпирта, не подкармливайте pастения другими азотными удобрениями. Это может привести к накоплению нитратов в плодах и листьях.
Нашатырный спирт – нестандартное, но очень эффективное средство для подкормки многих овощных культур. Аптечный препарат способен оказать укрепляющее и питательное действие на большинство огородных pастений.
При правильном применении, он не способен навредить растениям и соответственно, не опасен для здоровья человека
Но важно помнить об отличии дозировки для лечения и профилактики. Выполнение базовых правил позволит повысить урожайность и уменьшить вред от действия насекомых
Использование спирта
Основной сферой использования нашатыря являются медицина и промышленность. На основе NH 4 OH изготавливаются различные чистящие средства и отбеливатели. Сегодня, когда в повседневной жизни широко используются синтетические и технические материалы, необходимость в применении спирта нашатырного только увеличилась.
В сельском хозяйстве применяются различные удобрения, выполненные с использованием нашатыря. Регулярные подкормки на основе NH 4 OH позволяют обеспечить растения азотом и другими необходимыми им микроэлементами. Также при помощи таких составов производятся инсектициды и средства для уничтожения садовых и домашних насекомых.
Примочки на основе нашатыря отлично избавляют от суставной боли, уменьшают воспалительные процессы и помогают при хронических заболеваниях костей. Последние исследования доказали эффективность этого средства при грибковых болезнях ногтевых пластин. Наружное применение лекарственных средств на основе препарата помогает при миалгии, различных нервных расстройствах, головной боли и других патологиях.
Моногидрат аммиака применяется в косметологии, где на его основе изготавливаются мази и лосьоны для сухой кожи, а также ополаскиватели для волос.
Аммиак в судебно-медицинском отношении
Аммиак может вызывать отравление в газообразном состоянии или при приемах внутрь в виде водных растворов. Клиническая картина при отравлении аммиаком (per os) сходна с той, которая наблюдается при отравлении едкими веществами, однако имеются особенности: характерен запах рвотных масс, насморк, слезотечение, сильный кашель; наблюдается парез нижних конечностей
При судебно-медицинском исследовании обращают внимание на ярко-красный цвет слизистой оболочки рта, глотки, пищевода и желудка, иногда принимающий более темную окраску. В легких наблюдается очаговая пневмония, в почках — явления острого нефрита.
При вскрытии трупа ощущается запах Аммиака, сохраняющийся в течение нескольких дней. Для судебно-химического качественного обнаружения аммиака используется способность его паров окрашивать в синий цвет красную лакмусовую бумажку и бумажку, смоченную раствором сульфата меди. Для исключения Аммиака, образующегося при гниении биол. объектов, параллельно проводится испытание с бумажкой, пропитанной раствором ацетата свинца. При этом возникает почернение в присутствии сероводорода, сопутствующего Аммиака при гниении. При посинении двух первых бумажек и потемнении третьей установление наличия поступившего в организм Аммиака химическим методом уже невозможно.
Количественное определение Аммиака при исследовании трупного материала, как правило, не может быть произведено.
Применение
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь
Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты
При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения.
Аммиачная вода — продукт (NH3*H2O), представляющий собой газообразный аммиак NН3, растворённый в воде.
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
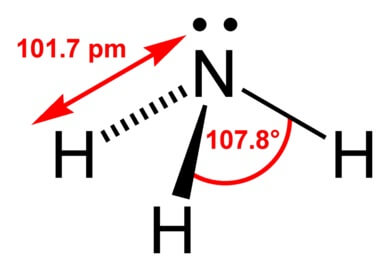
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Газообразный аммиак вызывает острое раздражение слизистых оболочек, слезотечение, отравление и удушье. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Польза и применение аммиака
Аммиак (NH3) — это бесцветный газ с резким запахом мочи. При соединении с водой, он образует новое вещество — нашатырный спирт (NH4OH). Именно его используют в качестве подкормки. В обиход садоводов прочно вошли названия аммиак, нашатырь и нашатырный спирт, обозначающие одно и то же, хотя на самом деле это разные вещества. Для упрощения будем использовать все 3 названия.
Купить препарат можно в аптеке или в магазине с садовым инвентарем. Продается он в виде 10% раствора и называется «Аммиак» или «Нашатырный спирт».
Почему же аммиак для огорода так часто используют? Его польза заключается в высоком содержании азота — основного составляющего органелл растений, липоидов и хлорофилла. Несмотря на большое количество свободного азота в воздухе (78%), растения усваивают его только в связанной форме — в виде химических соединений из почвы.
Применение нашатырного спирта на огороде столь популярным делает его резкий запах. Неприятен он не только для человека, но и для насекомых. Запах аммиака отпугивает тлю, медведку, луковую муху, скрытнохоботника.
Нашатырный спирт против вредителей на огороде
Для профилактики появления медведки на грядках капусты перед посадкой в каждую лунку вносят по пол литра 1% раствора нашатыря (для этого в ведре воды растворите 10 мл препарата).
Чтобы на участке не заводилась луковая муха и скрытнохоботник раз в неделю на протяжении июня поливайте грядки лука и чеснока аммиачным раствором (25 мл аммиака на 10 л холодной воды). Если есть высокая вероятность появления вредителей полив лука нашатырным спиртом можно продолжать все лето.
Если вы все-таки заметили признаки появления вредителей (дырки на листьях, мошек), нашатырь поможет быстро их уничтожить. Для этого в 10 л воды растворите 50 мл аммиака, добавьте 50 г тертого хозяйственного или 10 мл жидкого мыла. Опрыскивайте растения раз в несколько дней.
Применение нашатырного спирта в огороде в качестве подкормки
Засохшие и бледные листья, мелкие цветки, отсутствие плодов — вот самые характерные признаки нехватки азота в почве. Чтобы их устранить, растения подкармливают концентрированным раствором. Для приготовления удобрения в 10-литровом ведре теплой воды разводят 6 столовых ложек аммиака и перемешивают. Подкормку вносят под корень растений после полива, раз в неделю.
Если почва участка не очень плодородна и содержит мало азота, проводите профилактическую корневую подкормку раз в 2 недели. Для этого на ведро воды растворите 50 мл нашатырного спирта. Готовый раствор вносите после обильного полива. Особенно плодотворно сказывается такая подкормка на лилиях, луке, огурцах и моркови.















